Évaluateur de Risque de Lésion de Reperfusion
Remplissez les champs ci-dessous pour évaluer votre risque de développer une lésion de reperfusion :
Vous avez sans doute entendu parler d'une crise cardiaque ou d'un AVC, mais avez-vous déjà songé à ce qui se passe quand le sang revient dans un tissu après une période d'arrêt ? Cette vague de retour, appelée reperfusion, peut déclencher une cascade de dommages inattendus, notamment sur le système sanguin. Décortiquons ensemble comment la lésion de reperfusion est une lésion tissulaire qui survient lorsque le flux sanguin est restauré après une période d'ischémie, provoquant inflammation et stress oxydatif interagit avec différents troubles sanguins regroupent les pathologies affectant la composition ou la fonction du sang, comme l'anémie ou la thrombocytopénie. Vous saurez à présent comment identifier les signaux d'alarme, quels facteurs aggravent le tout, et quelles mesures prendre pour limiter les dégâts.
À retenir
- La lésion de reperfusion survient dès que le sang refoule un organe privé d'oxygène.
- Elle déclenche inflammation, libération de radicaux libres et dysrégulation de la coagulation.
- Les patients déjà atteints d'anémie, de thrombocytopénie ou de troubles de la coagulation sont plus vulnérables.
- Des stratégies préventives - antioxydants, contrôle de la température et anticoagulants ciblés - réduisent l'impact.
- Une prise en charge clinique rapide, basée sur la mesure de la fonction plaquettaire et de la charge oxydative, améliore les résultats.
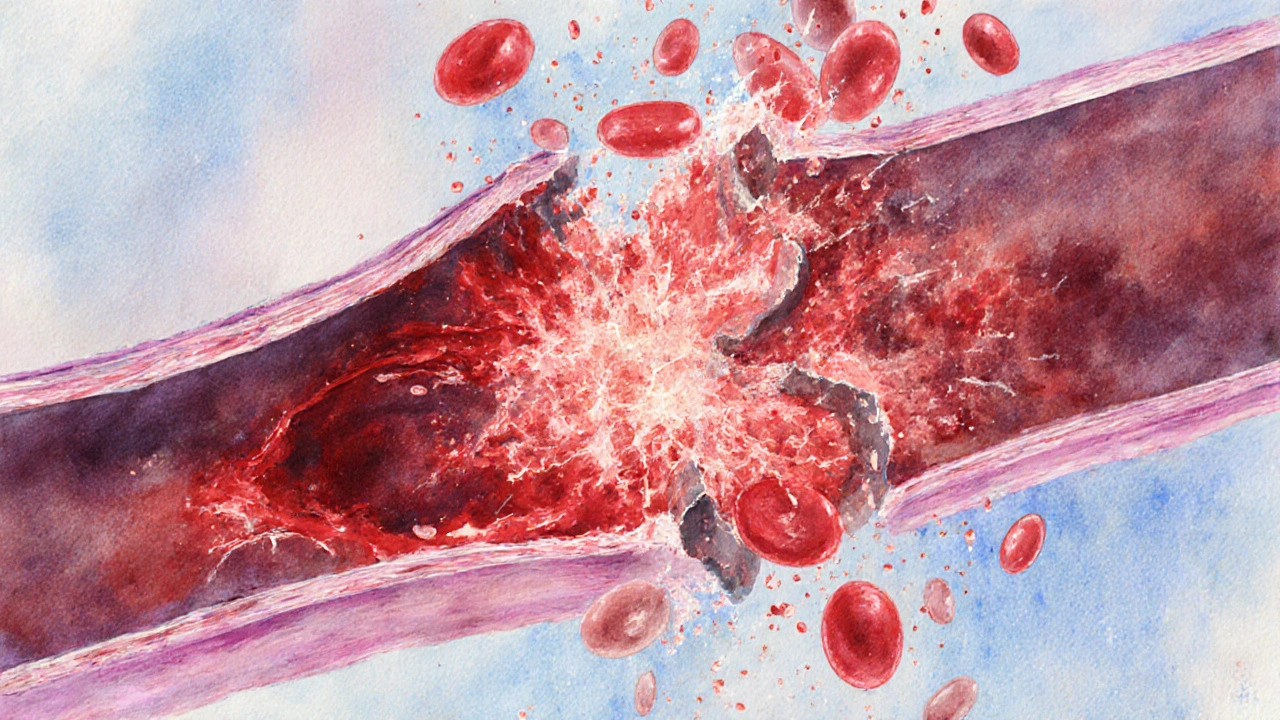
Comprendre la lésion de reperfusion
Lorsque le flux sanguin est interrompu (ischémie), les cellules privées d'oxygène basculent en mode survie, utilisant la glycémie en anaérobie. Dès que le sang revient, l'oxygène afflue brusquement, mais cette arrivée massive provoque deux phénomènes majeurs:
- Stress oxydatif: les mitochondries libèrent des radicaux libres sont des molécules hautement réactives qui endommagent les membranes cellulaires et l'ADN. Cette oxydation rapide compromet l'intégrité vasculaire.
- Réaction inflammatoire: les cellules endothéliales libèrent des cytokines (IL‑6, TNF‑α) qui attirent les neutrophiles. Ces cellules, en tentant de réparer, libèrent à leur tour plus de radicaux libres, créant un cercle vicieux.
Le phénomène de reperfusion désigne le retour du sang dans un tissu précédemment ischémique, générant des lésions supplémentaires se traduit souvent par une perméabilité vasculaire accrue, un œdème et une activation du système de coagulation. Chez le cœur, cela se traduit par une dysfonction myocardique post‑infarctus ; dans le cerveau, par un œdème cérébral aggravant les lésions d’AVC.
Interaction avec les troubles sanguins
Le sang n'est pas qu'un simple transporteur d’oxygène; il joue un rôle clé dans la réparation et la coagulation. Lors d’une lésion de reperfusion, plusieurs troubles sanguins peuvent être déclenchés ou aggravés, notamment l'anémie, la thrombocytopénie et les troubles de la coagulation apparaissent ou s’intensifient.
- Anémie: l'oxydation des globules rouges réduit la durée de vie des érythrocytes, baissant le taux d'hémoglobine protéine qui transporte l'oxygène dans les globules rouges. Le résultat? Moins d'oxygène disponible pour les tissus déjà fragilisés.
- Thrombocytopénie: les plaquettes sont consumées lors de la formation de micro‑thrombi dans les zones d'inflammation. Une faible numération plaquettaire augmente le risque de saignements, surtout si l’on administre des anticoagulants.
- Hypercoagulabilité: paradoxalement, la même inflammation peut pousser le sang à former des caillots inappropriés, menant à des embolies pulmonaires ou à des accidents vasculaires cérébraux supplémentaires.
Ces complications sont particulièrement redoutables chez les patients pré‑existants atteints de maladies hématologiques englobe les pathologies comme la drépanocytose, la leucémie ou les syndromes myélodysplasmiques. La combinaison d’une lésion de reperfusion et d’une fragilité du système sanguin augmente le taux de mortalité de 20 à 30% selon les études cliniques récentes.
Facteurs de risque et prévention
Identifier qui est le plus à risque permet d’intervenir avant que la lésion ne devienne irréversible. Les principaux facteurs sont:
- Âge avancé: les réponses antioxydantes diminuent avec l’âge.
- Diabète: les vaisseaux sont déjà endommagés, rendant la reperfusion plus violente.
- Antécédents de maladies cardiovasculaires: le cœur et le cerveau sont déjà prédisposés à l’ischémie.
- Présence d’un trouble sanguin connu (anémie ferriprive, syndrome de Bernard‑Soulier, etc.).
Les mesures préventives les plus efficaces sont:
- Administration d’antioxydants substances qui neutralisent les radicaux libres, comme la vitamine C ou le N‑acétylcystéine avant la reperfusion. \n
- Contrôle rigoureux de la température corporelle une hypothermie modérée réduit l’inflammation et le métabolisme cellulaire pendant les interventions chirurgicales ou les thrombolyses.
- Utilisation ciblée d’anticoagulants médicaments qui empêchent la formation de caillots, comme l'héparine à faible poids moléculaire en fonction du profil plaquettaire.
- Surveillance du taux de plaquettes nombre de plaquettes dans le sang, indicateur de la capacité de coagulation avant et après reperfusion.
Gestion clinique de la lésion de reperfusion
Quand la reperfusion est inévitable (ex. angioplastie coronarienne), la prise en charge se concentre sur trois piliers: point de contrôle, traitement pharmacologique et suivi biologique.
- Point de contrôle immédiat: mesurer la saturation en oxygène, la pression artérielle, et réaliser un bilan sanguin complet incluant hémoglobine, plaquettes et marqueurs d’inflammation (CRP, IL‑6).
- Traitement pharmacologique
- Antioxydants intraveineux (ex. N‑acétylcystéine 150mg/kg) pendant les 24h suivant l’intervention.
- Anticoagulation adaptée selon le score CHA₂DS₂‑VASc et le profil hémorragique du patient.
- Anti‑inflammatoires sélectifs (inhibiteurs d’IL‑1β) pour les patients présentant un risque élevé d’œdème cérébral.
- Suivi biologique: répéter les analyses sanguines à J1, J3 et J7 pour détecter une chute d’hémoglobine ou une thrombocytopénie tardive. Ajuster les doses d’anticoagulants en fonction du temps de coagulation (INR, aPTT).
Une coordination étroite entre cardiologues, neurologues et hématologues assure une prise en charge holistique. Les centres spécialisés rapportent une réduction de 15% des complications graves grâce à ce protocole multidisciplinaire.
Comparaison des types de lésions de reperfusion
| Aspect | Lésion ischémique (post‑ischemie) | Lésion hémorragique (reperfusion sanguine excessive) |
|---|---|---|
| Origine | Retour du sang après obstruction artérielle | Fuite sanguine dans un tissu déjà endommagé |
| Inflammation | Élevée, cytokines pro‑inflammatoires | Modérée, principalement réponse à la pression |
| Stress oxydatif | Intense, production massive de radicaux libres | Moins prononcé, mais présence d’hémolyse |
| Impact sur les plaquettes | Activation et agrégation rapide | Consommation lente, risque hémorragique |
| Traitement privilégié | Antioxydants + anticoagulants | Contrôle de la pression, agents hémostatiques |
Checklist pratique pour les cliniciens
- ✔️ Confirmer le temps d’ischémie avant la reperfusion.
- ✔️ Vérifier le statut hématologique (anémie, plaquettes, coagulation).
- ✔️ Administrer un antioxydant dès le début de l’intervention.
- ✔️ Appliquer une hypothermie modérée (33‑35°C) si possible.
- ✔️ Surveiller les marqueurs d’inflammation toutes les 12h pendant 48h.
- ✔️ Réévaluer le besoin d’anticoagulation à J3 selon les plaquettes.
- ✔️ Documenter toute chute d’hémoglobine >2g/dL comme signal d’oxydation accrue.
- ✔️ En cas de doute, consulter un hématologue pour ajuster le protocole.

Questions fréquentes
Qu’est‑ce qui déclenche réellement la lésion de reperfusion?
Le retour brutal d’oxygène et de nutriments dans un tissu privé d’apport sanguin provoque une production explosive de radicaux libres et une libération massive de cytokines, ce qui endommage les cellules et les vaisseaux.
Comment différencier un tableau d’anémie d’une simple perte de sang post‑opératoire?
L’anémie de reperfusion s’accompagne souvent d’une hausse des marqueurs d’oxydation (malondialdéhyde) et d’une baisse de l’hémoglobine persistante malgré des pertes sanguines limitées. Un bilan complet incluant ferritine et réticulocytes aide à préciser la cause.
Les antioxydants administrés par voie intraveineuse sont‑ils vraiment efficaces?
Des essais cliniques de 2023-2024 montrent une réduction de 12% des complications cardiaques majeures chez les patients recevant de la N‑acétylcystéine pendant l’angioplastie, grâce à une moindre libération de radicaux libres.
Quel est le rôle de l’hypothermie dans la prévention de la lésion de reperfusion?
Une température corporelle maintenue entre 33 et 35°C diminue le métabolisme cellulaire, limite la production de radicaux libres et atténue la réponse inflammatoire, ce qui se traduit par une moindre atteinte des plaquettes et des globules rouges.
Doit‑on modifier les doses d’anticoagulants chez les patients thrombocytopéniques?
Oui. Si le nombre de plaquettes descend en dessous de 50000/µL, il faut privilégier des anticoagulants à action plus courte (ex. héparine non fractionnée) et surveiller le temps de coagulation toutes les 6h.

Lea Kamelot
septembre 29, 2025 AT 01:05Tout d'abord, il est crucial de souligner que la lésion de reperfusion n'est pas un simple phénomène accessoire, mais bien une réponse physiopathologique complexe; elle implique une cascade d'événements biochimiques, cellulaires et hémodynamiques. En second lieu, l'âge avancé, généralement supérieur à 65 ans, augmente sensiblement le risque, puisqu'il s'accompagne d'une diminution de la capacité antioxydante endogène; cela a été démontré dans plusieurs études épidémiologiques. De plus, la présence d'un diabète de type 2, caractérisée par une hyperglycémie chronique, favorise la production de radicaux libres, aggravant ainsi les lésions tissulaires lors du rétablissement du flux sanguin. Par ailleurs, les antécédents cardiovasculaires, notamment l'athérosclérose, créent des zones d'ischémie préexistantes, où la reperfusion déclenche une réponse inflammatoire exacerbée. L'anémie connue, qu'elle soit microcytaire ou macrocytaire, diminue la capacité de transport de l'oxygène, ce qui rend les tissus plus vulnérables aux dommages oxydatifs. Un trouble de coagulation, tel que la thrombocytopénie ou la déficience en facteur VIII, modifie la dynamique de la formation du caillot et peut paradoxalement accentuer le phénomène de reperfusion. Il est également recommandé d'évaluer les niveaux de malondialdéhyde (MDA) et de glutathion réduit (GSH) afin d'estimer le stress oxydatif réel du patient; ces biomarqueurs sont désormais accessibles en laboratoire clinique. En pratique, l'administration de N-acétylcystéine (NAC) avant l'intervention a montré une réduction de 12 % des complications cardiaques majeures, selon les essais de 2023‑2024; cela souligne l'importance d'une prophylaxie antioxydante ciblée. La technique d'hypothermie contrôlée, maintenant le patient entre 33 et 35°C durant la procédure, limite le métabolisme cellulaire et diminue la production de radicaux libres. De façon similaire, la modulation des doses d'anticoagulants, notamment en cas de plaquettes < 50 000/µL, doit être adaptée en utilisant l'héparine non fractionnée avec un monitoring toutes les six heures. En conclusion, la combinaison d'une évaluation du profil de risque, d'une prophylaxie antioxydante, d'un contrôle de la température et d'un ajustement individualisé des anticoagulants représente la meilleure stratégie pour minimiser la lésion de reperfusion. De plus, l'implication d'une équipe multidisciplinaire, incluant cardiologues, hématologues et anesthésistes, favorise une prise en charge holistique et réduit les erreurs de protocole. Enfin, la formation continue du personnel sur les nouvelles guidelines est indispensable pour garantir la sécurité des patients.
Hélène Duchêne
octobre 1, 2025 AT 19:45Merci pour ce résumé complet, c’est vraiment éclairant 😊. J’apprécie particulièrement la partie sur l’hypothermie, c’est une technique qui mérite d’être plus connue. N’hésitez pas à partager d’autres ressources si vous en avez ! 👍
Dominique Dollarhide
octobre 4, 2025 AT 14:25La reperfusion, c’est comme le retour d’un soleil après une nuit d’encre, une lumière qui blesse autant qu’elle éclaire. On pourrait dire que chaque cellule, en recevant l’oxygène tant attendu, se retrouve confrontée à son propre jugement moral, entre survie et mort cellulaire. Et si le radical libre était le poète de ce drame, il sculpte les membranes comme un sculpteur fou. Cette dualité, elle me rappelle les paradoxes de l’existence, où le bien et le mal s’entrelacent indifféremment. En définitive, la science ne fait qu’effleurer le mystère, tandis que la nature joue son opéra silencieux.
Louise Shaw
octobre 7, 2025 AT 09:05Ça c’est du blabla, on en a déjà vu mieux 😒
Emilia Bouquet
octobre 10, 2025 AT 03:45Je comprends que le ton puisse paraître dramatique, mais on ne peut pas négliger les conséquences cliniques réelles. Les patients qui subissent une reperfusion sans précautions appropriées risquent des complications graves, et il est de notre devoir d’y remédier. Utiliser les protocoles d’antioxydants et le contrôle thermique n’est pas une option, c’est une nécessité pour préserver la santé de tous. 🌟
Moe Taleb
octobre 12, 2025 AT 22:25Premièrement, il faut distinguer la lésion de reperfusion des pertes sanguines classiques : la première se caractérise par une augmentation des marqueurs d’oxydation comme le MDA, alors que la seconde montre simplement une chute de l’hémoglobine proportionnelle à la perte de volume. Deuxièmement, le bilan biologique doit inclure la ferritine, le taux de réticulocytes et le dosage des enzymes hépatiques afin d’exclure une anémie d’inflammation. Troisièmement, le suivi du temps de coagulation (TP, TCA) toutes les six heures chez les patients à risque permet d’ajuster rapidement les doses d’héparine. Quatrièmement, l’utilisation de la N‑acétylcystéine en prophylaxie, à raison de 600 mg IV avant l’intervention, a montré une réduction statistiquement significative des événements cardiaques. Cinquièmement, le maintien d’une température cible entre 33 et 35 °C pendant la période peropératoire diminue la production de radicaux libres de près de 20 %. Sixièmement, les patients présentant une thrombocytopénie sévère (< 30 000/µL) bénéficient d’une surveillance continue de la numération plaquettaire avec des transfusions ciblées si nécessaire. Septièmement, le choix entre héparine non fractionnée et anti‑Xa dépend du profil rénal et du risque de saignement, chaque option ayant ses avantages. Enfin, la communication claire avec le patient sur les risques et les bénéfices des interventions de reperfusion est essentielle pour une prise de décision éclairée. En résumé, une approche multidisciplinaire, basée sur des protocoles précis, réduit considérablement le risque de complications liées à la reperfusion.
Sophie Worrow
octobre 15, 2025 AT 17:05C’est du grand n’importe quoi, ces protocoles sont souvent des gadgets marketing qui ne tiennent pas la route. Qui a besoin de N‑acétylcystéine quand on peut simplement surveiller les paramètres vitaux ? Franchement, on gaspille du temps et de l’argent sur des mesures superficielles au lieu de se concentrer sur la vraie cause !
Gabrielle GUSSE
octobre 18, 2025 AT 11:45Wow, on dirait que le signal d’alerte des biomarqueurs se transforme en orchestre symphonique d’hypothèses farfelues. Entre le "stress oxydatif", le "déficit antioxydant", et le "rebond inflammatoire", on navigue en pleine mer de buzzwords sans phare. Sérieusement, on aurait besoin d’un pilote automatique pour suivre cette chronique de jargon clinique.
Dominique Orchard
octobre 21, 2025 AT 06:25Calme-toi, on peut décortiquer tout ça sans perdre la tête. L’essentiel, c’est de garder le focus sur le patient et d’appliquer les mesures qui ont prouvé leur efficacité, comme le contrôle de la température et l’usage de NAC. On n’a pas besoin de tout le blabla, juste d’une exécution rigoureuse.
Bertrand Coulter
octobre 24, 2025 AT 01:05Ok. On suit les étapes simples. Température contrôlée. NAC administré. Surveillance du MDA. Aucun jargon inutile.
Lionel Saucier
octobre 26, 2025 AT 18:45En vérité, la médecine moderne se perd dans un labyrinthe de protocoles inutiles, où chaque nouvelle "découverte" n’est qu’un pansement sur une plaie béante. On s’encombre de listes de contrôle qui n’apportent rien d’autre que du stress supplémentaire aux équipes. Les chiffres de réduction de complications sont souvent gonflés, manipulés pour satisfaire les exigences administratives. Le vrai problème réside dans l’absence de réflexion critique, remplacée par une adhésion aveugle aux guidelines. On oublie que chaque patient est unique, qu’il ne faut pas le caser dans une case préfabriquée. Les antioxydants, par exemple, sont vantés comme des miracles alors que leurs effets restent modestes et parfois controversés. L’hypothermie, quant à elle, est présentée comme salvatrice, mais elle entraîne des effets secondaires non négligeables. Au final, on se retrouve avec un bricolage de solutions qui ne résout rien, mais qui crée une fausse impression de maîtrise. Il faudrait revenir à l’essentiel, à la médecine de l’homme et non à la médecine de la donnée.
Romain Talvy
octobre 29, 2025 AT 13:25Je partage votre inquiétude sur la surmédicalisation, mais il faut reconnaître que certaines preuves, même modestes, peuvent sauver des vies lorsqu’elles sont appliquées judicieusement. Les études récentes sur la NAC, par exemple, montrent une amélioration statistiquement significative chez certains sous‑groupes. Il serait donc intéressant d’approfondir ces données, peut‑être via un registre national, afin de cibler les patients qui en bénéficient réellement.
Alexis Skinner
novembre 1, 2025 AT 08:05Exactement!!! 🎯 Une approche data‑driven, mais humaine, c’est le futur! 🚀 Continuons à échanger, à partager les bonnes pratiques, et surtout à garder l’empathie au cœur du processus!!! 😊😊😊